Болезнь куру лечение, Мутация, защищающая от всех известных прионных болезней

Можно выделить две формы этой болезни: генетическую и спорадическую. К некоторым видам острой энцефалопатии относятся: печеночная энцефалопатия, почечная энцефалопатия , гипертоническая энцефалопатия, Хашимото и Вернике. Проект «Биомолекулы» и Forbes.
Нарушения мозговой функции диагностируются после неврологического обследования, психиатрической консультации, лабораторных обследований. Основной перечень диагностических мероприятий, предшествующих лечению:. Тактика лечения основывается на результатах обследования, установлении типа энцефалопатии, тяжести состояния больного.
Врач может порекомендовать лечение, влияющее на причину возникновения энцефалопатии. Консервативное лечение в основном направлено на устранение причин энцефалопатии, замедление процессов дистрофии головного мозга за счет устранения ишемии, снижения артериального давления и улучшения кровообращения. Но прежде всего, больному необходимо изменить образ жизни — отказаться от алкоголя и курения, изменить рацион питания, повысить физическую активность.
Медикаментозная терапия предполагает прием антибиотиков, противосудорожных препаратов, витамина В1 и др. Если болезнь привела к повреждению головного мозга, то возможно понадобятся: Физиотерапия, когнетивно- поведенческая терапия, занятия с логопедом.
В зависимости от вида энцефалопатии, облегчение симптоматики может наступить уже через дня после начала лечения, в других случаях могут понадобиться месяца, а иногда человек не может вернуться к прежнему состоянию. Основными показаниями для хирургического лечения энцефалопатии являются тяжелые нарушения функции почек и печени.
Одним из основным методов хирургического лечения является трансплантция этих органов. Лечение стволовыми клетками Гипоксически-ишемической энцефалопатии, является экспериментальным на протяжении более десятка лет. Большинство из исследований находились на уровне доклинических и только два исследования проводились среди младенцев, в первые часы- дни после рождения.
Официальный сайт агентства медицинского туризма ИсрамедикТурмед, аккредитованного в клинике Ассута. Информация, предоставленная на сайте, не должна использоваться в качестве рекомендаций по лечению.
Самолечение опасно для вашего здоровья! All Rights Reserved. Заказать звонок. Обратная связь. Контактные данные для получения информации и записи на лечение в больнице "Ассута". Заполните форму:. Наши контакты. Лечение энцефалопатии в Израиле Энцефалопатия охватывает широкий спектр симптомов, связанных с заболеванием, повреждением или дисфункцией головного мозга. Основные виды энцефалопатии В медицинской литературе встречается более различных состояний, подходящих под определение «энцефалопатия».
Диагностика энцефалопатии в «Ассуте» Диагностика может отличаться, в зависимости от того, какой вид энцефалопатии подозревают. Нехирургические методы лечения Консервативное лечение в основном направлено на устранение причин энцефалопатии, замедление процессов дистрофии головного мозга за счет устранения ишемии, снижения артериального давления и улучшения кровообращения.
Лечение энцефалопатии стволовыми клетками Лечение стволовыми клетками Гипоксически-ишемической энцефалопатии, является экспериментальным на протяжении более десятка лет. С Вами всегда на связи наш консультант бесплатная консулЬтация КонсулЬтация. Ха-Барзель Работаем: Вс - Пт: с до Сб: выходной. E-mail: info assutahospital. Карта сайта Закон о правах больного Политика конфиденциальности. Если вы посетили наш сайт, то скорее всего вас интересует варианты лечения данного заболевания.
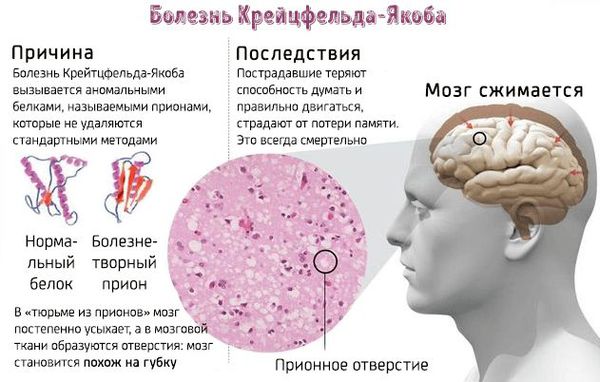
Просьба отнестись с пониманием к контенту сайта, который не обновляется с той периодичностью с которой появляются новые методики лечения заболевания! С прионами связывают группу сравнительно редких, хотя и достаточно известных заболеваний, таких как болезнь Крейцфельдта—Якоба, куру, коровье бешенство и скрейпи овец.
Однако не для всех живых организмов прионы вредны. Так, у дрожжей — одноклеточных микроскопических грибов — прионы не несут значительного вреда клетке, а иногда даже могут быть полезны, увеличивая ее устойчивость к неблагоприятным условиям окружающей среды. Изучение прионов и амилоидов на животных моделях — длительный, трудоемкий и даже опасный процесс, из-за чего он требует высокого уровня лабораторной защиты.
Прионы дрожжей не имеют этих недостатков и потому являются удобной моделью для ученых. Данные, полученные с их помощью, можно использовать для разработки лекарств от нейродегенеративных заболеваний. Ученые из федерального исследовательского центра «Фундаментальные основы биотехнологии» Российской академии наук Москва проанализировали множество работ, изучающих свойства прионов дрожжей, и обобщили их результаты в виде обзора.
В нем авторы постарались дать максимально полную картину молекулярного устройства данных белков и механизмов их взаимодействия с клеткой. Так, в статье подробно описан наиболее изученный прион дрожжей — Sup35, который участвует в контроле синтеза белков.
Если в геноме микроорганизма случайно возникает мутация, преждевременно завершающая синтез белка, прион Sup35 позволяет преодолеть это нарушение. Например, дрожжи с мутацией гена ade не способны синтезировать аденин из-за того, что этот процесс прерывается в определенном месте, соответствующем мутации в гене.
Это приводит к накоплению промежуточного продукта — пигмента, который придает красный цвет колониям дрожжей. Однако, если в клетке есть прион Sup35, он помогает «преодолеть» мутацию ade и довести синтез аденина до конца.
В результате окрашенный продукт не накапливается и цвет колоний меняется на белый или различные оттенки розового, в зависимости от «силы» приона. В обзоре авторы наглядно представляют структуру приона Sup35 и белков, взаимодействующих с ним.
Вероятно, впервые такой рисунок удалось представить с соблюдением всех молекулярных пропорций.
Он позволил исследователям продемонстрировать уникальную особенность амилоидов: очень плотную упаковку белковых молекул в амилоидной фибрилле. Так, одна белковая молекула в составе амилоида занимает в 11 раз меньшее пространство по длине фибриллы, чем молекула актина в пучке мышечных волокон. В связи с этим на рисунке удалось разместить лишь малую долю от количества молекул, взаимодействующих с прионом Sup Столь плотная упаковка должна накладывать ограничения на взаимодействие амилоида с другими молекулами, в частности, с белками-шаперонами, которые пытаются «бороться» с прионами, растворяя их.
Весьма любопытно, что эта борьба обычно дает противоположный результат, помогая прионам размножаться.
Интересное свойство прионов дрожжей, как и всех амилоидов, состоит в том, что, если из этой плотной структуры извлечь всего одну входящую в нее белковую молекулу, что делает шаперон Hsp, прион распадется на две части. При этом оба получившихся фрагмента остаются способными «заражать» нормальные белки.
Именно так и происходит размножение прионных частиц. Применительно к дрожжам этот процесс необходим для того, чтобы прионы в равной мере доставались при делении дочерним клеткам. В организме человека разделение прионов и амилоидов на более мелкие и более мобильные фрагменты позволяет им легче распространяться в пределах организма.
Также множество данных говорит о том, что они более токсичны. Прионные белки дрожжей обычно содержат две части.

Одна из них, сравнительно небольшая, образует амилоидный стержень приона. Другая отвечает за функцию белка, и эта функция уменьшается или модифицируется, когда нормальный белок превращается в прион.
Многочисленные исследования показали, что, когда эта функциональная область находится в самом начале или в конце белка, ее переход в прионную форму происходит более охотно. Но авторы обзора обнаружили еще более яркое явление: если из-за мутации синтез белка преждевременно завершается сразу после прионогенной области, помещая ее на конец белка, то частота первичного появления приона возрастает в раз.
Это наблюдение подкрепляет и детализирует одну из популярных гипотез появления амилоидов у человека в результате соматических мутаций. И расчеты показывают, что число клеток с такими мутациями, которые могут быть очагами возникновения амилоидоза, в организме каждого человека исчисляется миллионами.

Виталий Кушниров , доктор биологических наук, ведущий научный сотрудник лаборатории молекулярной генетики федерального исследовательского центра «Фундаментальные основы биотехнологии» РАН, ответил на вопросы «Ъ-Науки»:. Амилоиды встречаются гораздо чаще, но слово «прион» у всех на слуху. Вероятно, это связано с удивительным свойством прионов являться инфекцией, не имея какой-либо генетической программы в виде ДНК или РНК, как у всех прочих инфекционных агентов, вирусов, бактерий, микроорганизмов.
Но различия прионов и амилоидов сугубо количественные. Инфекционность прионов связана с их способностью катализировать структурное превращение такого же, но растворимого белка, и расти, присоединяя его к себе. Это свойство характерно и для амилоидов. У человека известно более сорока белков, способных образовывать патологические амилоиды. Соответствующие болезни, амилоидозы, возникают обычно в зрелом возрасте, и на данный момент не существует способов их лечения.
Наиболее известны из них болезни Альцгеймера и Паркинсона, и многие амилоидозы проявляются в нарушении работы мозга. Но также амилоиды являются причиной диабета второго типа, а в некоторых случаях они могут быть как причиной, так и следствием рака. Все «прионные» болезни человека связаны с одним лишь белком — PrP. Тем не менее они могут иметь разные проявления и называться по-разному.
Так, болезнь куру связана с ритуальным каннибализмом у племен Новой Гвинеи, а болезнь Крейцфельдта—Якоба возникает спонтанно.